Tabel periodik unsur adalah susunan unsur kimia dalam yang disusun berdasarkan kenaikan nomor atom. Tabel periodik unsur disusun untuk lebih memudahkan dalam mempelajari sifat-sifat unsur karena sistem penyusunannya dilakukan berdasarkan kesamaan sifat dari unsur-unsur tersebut.
Tabel periodik unsur moderen disusun karena adanya perbedaan tabel periodik unsur yang berlaku di wilayah amerika dan eropa. Tabel periodik ini memiliki perbedaan pada penomoran golongan. Pada Tabel periodik unsur Amerika dan Eropa, sistem penomoran dilakukan dengan sistem A dan B. Penomoran IA dan IIA (unsur golongan alkali dan alkali tanah) berlaku sama baik pada tabel periodik Amerika maupun Eropa. Perbedaan terjadi pada penomoron golongan unsur setelah golongan unsur alkali dan alkali tanah tersebut.
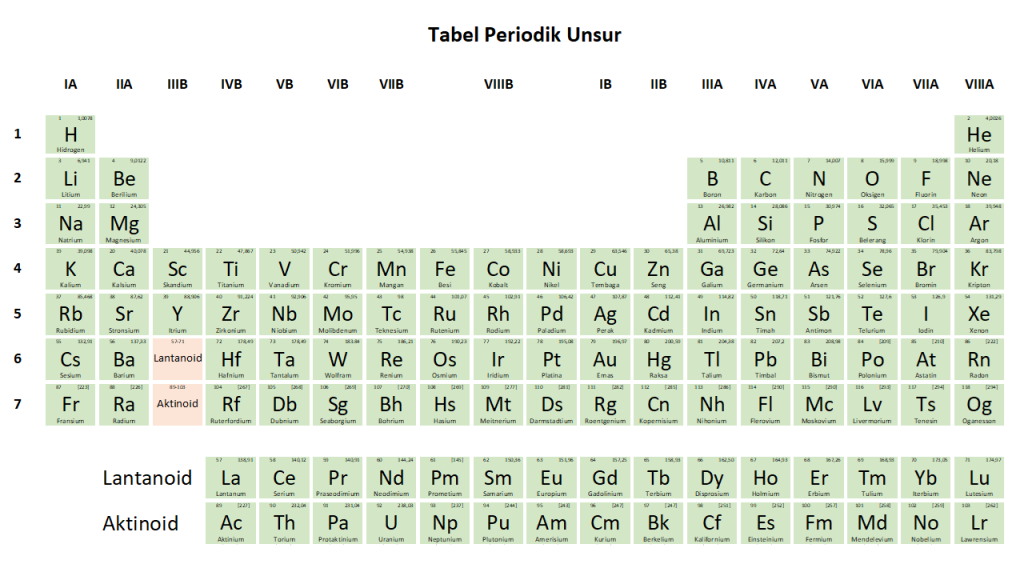
Gambar 1. Tabel Periodik sistem penomoran Amerika (Sebelum tahun 1988).
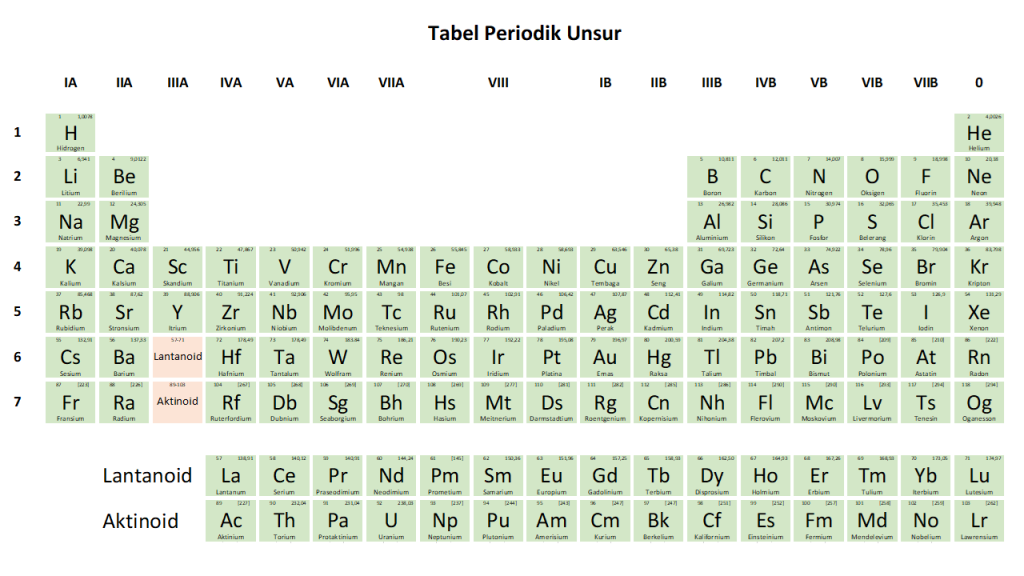
Gambar 2. Tabel Periodik sistem penomoran Eropa (Sebelum tahun 1988).
Pada penomoran tabel periodik dengan sistem penomoran Amerika, penomoran selanjutnya menggunakan nomor B untuk unsur trasisi dan Penomoran A untuk golongan unsur Utama (Gambar 1). Sedangkan penomoran tabel periodik dengan sistem penomoran Eropa, penomoran golongan transisi melanjutkan penomoran golongan unsur alkali dan alkali tanah, yaitu IIIA, dan seterusnya. Golongan unsur utama menggunakan sistem penomoran B (Gambar 2).
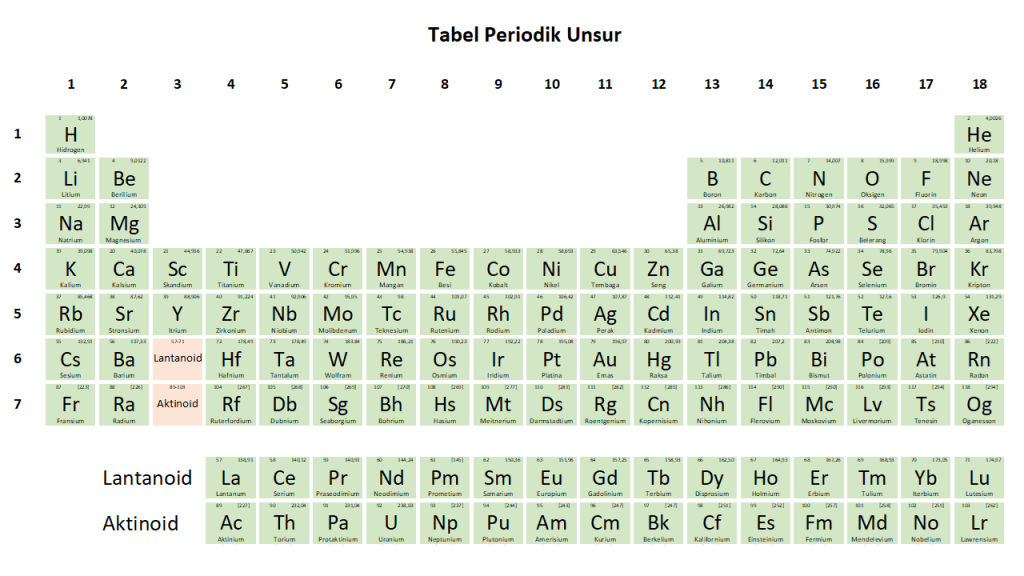
Gambar 3. Tabel Periodik Unsur Moderen berdasarkan sistem penomoran IUPAC (mulai tahun 1988).
Adanya perbedaan dalam kedua sistem penomoran tersebut, menyebabkan adanya kebingungan dalam memahami tabel periodik. Oleh karena itu IUPAC pada tahun 1988 menyepakati penomoran baru untuk Tabel periodik unsur dengan menggunakan angka Arab yaitu, 1, 2, 3, dan seterusnya hingga 18 (Gambar 3). Sistem inilah yang dikenal dengan istilah Tabel Periodik Unsur Moderen.
Ketiga Tabel periodik unsur dengan sistem penomoran berbeda tersebut, dapat digabungkan menjadi satu seperti terlihat pada Gambar 4. Pada Gambar 4 tersebut ditunjukkan adanya perbedaan sistem penomoran golongan unsur dengan warna yang berbeda.
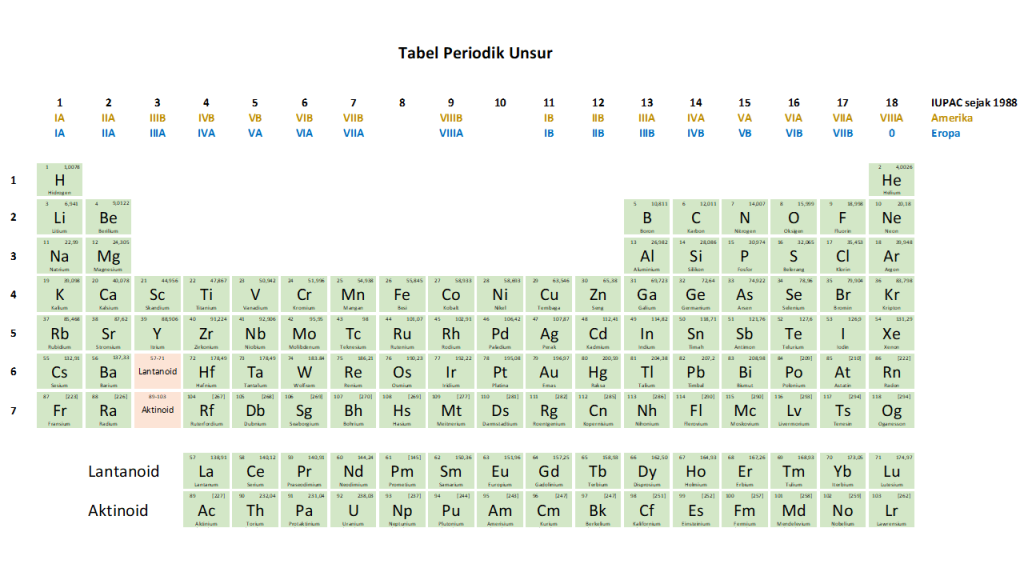
Gambar 4. Tabel Periodik Unsur berdasarkan sistem penomoran Amerika, Eropa, dan IUPAC tahun 1988.














